Sekundärfluoreszenz bei Grünalgen
Mein Artikel, veröffentlich in Mikrokosmos 1976
Die Sekundärfluoreszenz an Algen wird nur selten als Untersuchungsverfahren verwendet. Um für dieses Gebiet eine Lanze zu brechen, möchte ich die Technik kurz skizzieren.
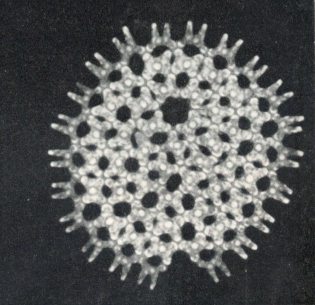
Abb.1: Grünalge Pediastrum, das Zackenrädchen
Es gibt in der Natur Stoffe, die, angeregt durch kurzwelliges Licht, langwelliges abgeben. Diese Erscheinung nennt man Fluoreszenz. Für die Praxis des Amateurs eignet sich besonders gut die Blaulichtfluoreszenz, da man als Lichtquelle eine Niedervoltlampe verwenden kann. Normale Mikroskopierlampen 6 A/5 V erweisen sich nur für die Histologie als brauchbar, für algologische Untersuchungen benötigt man stärkere Lichtquellen. Dazu fand ich eine kleine er Mikro-Halogenlampe 24 V/10 A als besonders geeignet; natürlich muss man die Lampe mit einem Gebläse kühlen. Selbstverständlich bietet uns der Handel fertige Einrichtungen für alle Gebiete der Fluoreszenzmikroskopie. Als Erregerfilter dient ein BG 12/6 mm (Schott), als Sperrfilter GG 9/1 mm +1/1,5 mm (Schott). In den Filterhalter legt man das BG 12. Nun wird das Präparat mit Blaulicht zur Fluoreszenz angeregt. Am Okular wird der Sperrfilter aufgesetzt, dieser sperrt das Blaulicht; sichtbar bleibt die Fluoreszenz des Präparates.
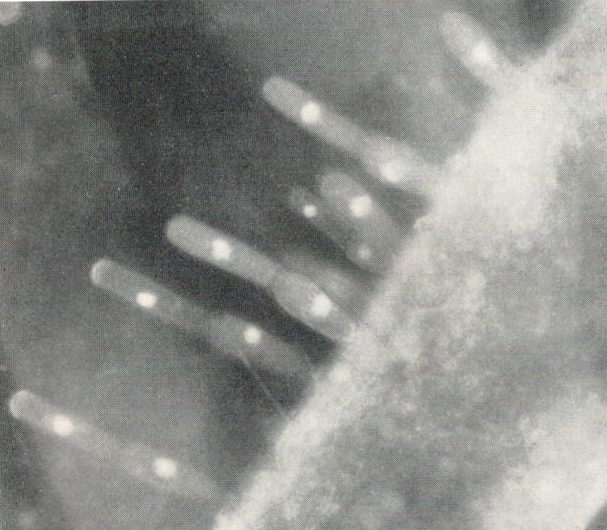
Abb.2: Aufwuchs von Oedogonium auf Pithophora. Darstellung der Zellkerne
Betrachtet man einen Grünalgenfaden unter dem Fluoreszenzmikroskop, so leuchtet das Chlorophyll blutrot auf. Man kann alle Einzelheiten wie bei einem Übersichtspräparat erkennen, natürlich nur dort, wo Chlorophyll vorhanden ist, da nur dieses fluoresziert. Diesen Vorgang nennt man Primärfluoreszenz oder Eigenfluoreszenz.
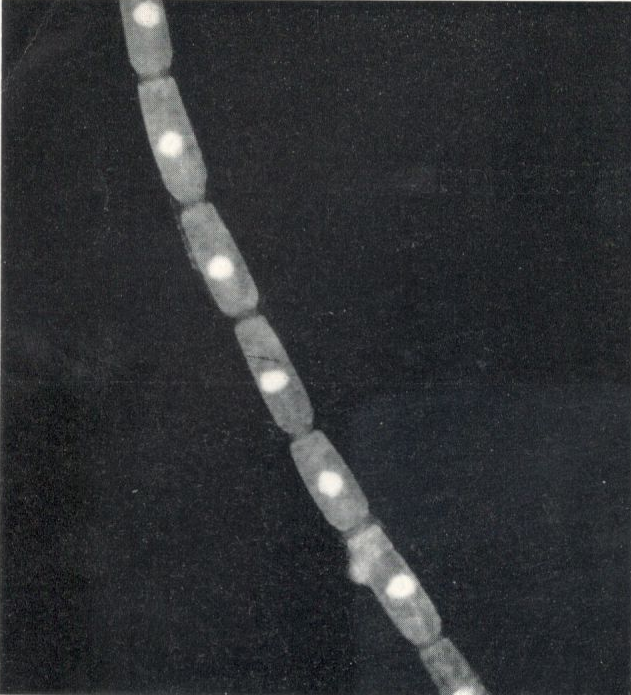
Abb.3: Oedogonium mit Zellkernen
Zellinhalte lassen sich nicht darstellen, zytologische Untersuchungen sind daher nicht möglich. Dazu muss man die Algen mit Fluorochromfarbstoffen behandeln. Zu diesem Zweck muss man das Chlorophyll restlos aus dem Material entfernen. Außerdem löschen einige Metallverbindungen die Fluoreszenz und man muß diese, sofern sie im Material vorhanden sind, ebenfalls entfernen. Ist dies alles geschehen, so kann man die Algen anschließend mit einem Fluorochromfarbstoff behandeln. Diesen Vorgang nennt man Fluorochromisierung (Sekundärfluoreszenz): Nicht die Objekte selbst fluoreszieren, sondern der Farbstoff, mit dem sie angefärbt sind. Das Gelingen setzt natürlich ein geeignetes Fixiermittel voraus, das das Material ausbleicht und den natürlichen Zustand der Zelle kaum verändert. Eisessig-Alkoholgemische erwiesen sich bei manchen robusten Arten als brauchbar, doch wäre noch einige Arbeit für ein breiteres Einsatzgebiet vonnöten. Als durchaus verwendbar erwies sich die Chromessigsäure nach Flemming, doch musste eine Nachbehandlung eingesetzt werden, welche das Fixiergemisch wieder aus der Zelle restlos entfernt. Bei manchen Arten wurde auch der Essigsäurezusatz bis auf das 4-fache erhöht, um Artefakte auszuschließen.
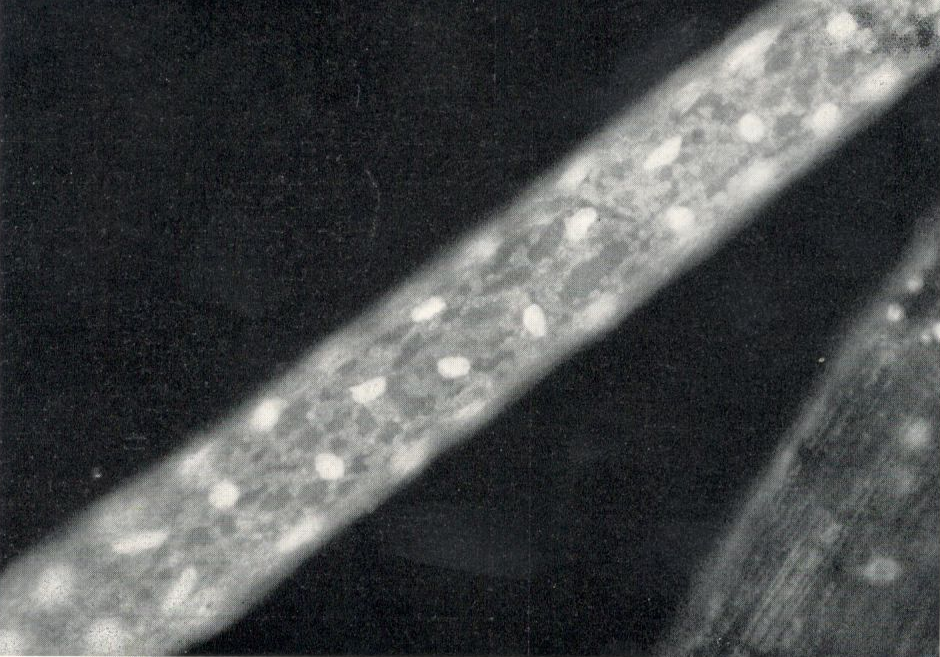
Abb.4: Pitophora kewensis mit Zellinhalten
Die Fixierzeit lag zwischen 20 und 60 Minuten. Nach dem Fixieren folgte gutes Waschen mit Leitungswasser, anschließend überführen des Materials in eine 0,5%-Natriumthiosulfatlösung. Von dieser kam das Material direkt in 2°/o Wasserstoffperoxid, danach in eine 2°/o ÄDTE-(Titriplex-III-)Lösung in destilliertem Wasser. Diese Lösung bildet mit Metallionen wasserlösliche Komplexe (Chelate), welche sich durch nachträgliches Spülen aus dem Material entfernen lassen. Das Material kann in dieser Lösung von 2 Stunden bis zu einigen Tagen belassen werden. Das so behandelte Material eignet sich gut für die Fluorochromierung. Als Fluorochrome werden Akridinfarbstoffe in einer Verdünnung von 1 : 10 000 verwendet. Das Material wurde direkt aus dem Wasser in die Farblösung gebracht, wo es 1 Minute verblieb. Sodann folgte gründliches Spülen und Einschluss in Wasser oder Glyzerin. Ergebnis: Gute Differenzierung von Cytoplasma und Zellkernen.
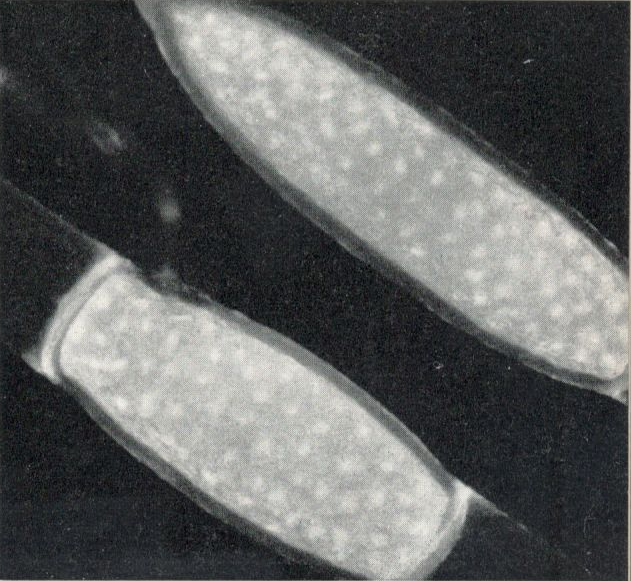
Abb.5: Akineten von Pithophora kewensis mit Zellinhalten
Zusammenfassung
1. Fixieren in Chromessigsäure nach Flemming, 20 bis 60 Minuten;
2. Auswaschen mit Leitungswasser
3. 0,5% Natriumthiosulfat, 5 Minuten
4. 2% Wasserstoffperoxid, 5 bis 10 Minuten
5. 2% Titriplex III (Fa. Merck, Darmstadt), 2 Stunden
6. Fluorochromierung des Materials mit Akridinorange, 1 : 10 000, 1 Minute
7. Einschluss in Wasser oder fluoreszenzfreies Glyzerin